(注:须于上课前二日写好)
部/院/系 化学学院 专业 化学 姓名 王娟 学号 201311151932
我校指导教师 李川 实习学校教学指导教师 吴峰 原任课教师 施鹏
2016年 10 月 16 日 (星期 一) 第 四 节课 本人本次实习第 5 个教案
|
实习学校
|
北师大贵阳附中
|
实习班级
|
高二(7)班
|
实习科目
|
化学
|
||
|
教学课题
|
水的电离和溶液的酸碱性
|
||||||
|
所用教材
|
教材名称: 化学选修四 ,第 3 章 2 节 45 页
出版社: 人民教育出版社
|
||||||
|
教学目标
|
知识与技能
1.了解水的离子积的含义;
2.理解水的电离;
3.初步学会有关水的离子积的简单计算;
4.认识溶液的酸、碱度与H+、OH-浓度,以及与pH的关系。
过程与方法
通过问题讨论,培养学生分析和归纳知识的能力。
情感态度与价值观
通过水的电离平衡过程中H+、OH- 的关系分析,体会矛盾的对立统一。
|
||||||
|
教学重点
|
1.理解水的电离以及水的离子积常数的含义,并能应用水的离子积常数进行相关计算;
2.认识溶液的酸、碱度与H+、OH-浓度,以及与pH的关系,进行相关的计算。
|
||||||
|
教学难点
|
1.能应用水的离子积常数进行相关计算;
2.认识溶液的酸、碱度与H+、OH-浓度,以及与pH的关系。
|
||||||
|
课时安排
|
1
|
教学用具
|
多媒体
|
||||
|
教学方法
|
口头讲授
小组合作交流
|
||||||
|
教
学
过
程
及
内
容
|
|
||||||||||||||||||||||||
|
|
|
||||||||||||||||||||||||
|
|
|
||||||||||||||||||||||||
|
|
|
||||||||||||||||||||||||
|
板
书
设
计
|
第三章 第二节 水的电离和溶液的酸碱性
一、水的电离
1.电离方程式
H2O ⇌ H++OH-
2.水的离子积
Kw = c(H+)·c(OH—)
3.影响水电离的因素
温度、c(H+)、c(OH—)
二、溶液的酸碱性
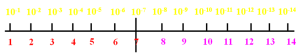
1.pH
pH= -㏒10c(H+)
室温下,25℃:
中性溶液 c(H+)="c(OH—)
c(H+)="1.0×10-7 mol·L-1 pH="7
酸性溶液 c(H+)>c(OH—)
c(H+)>1.0×10-7 mol·L-1 pH<7
碱性溶液 c(H+)<c(OH—)
c(H+)="1.0×10-7 mol·L-1 pH>
2.酸碱性判断
c(H+)="c(OH—),溶液呈中性;
c(H+)>c(OH—),溶液呈酸性,且c(H+)越大酸性越强;
c(H+)<c(OH—),溶液呈碱性,且c(OH-)越大碱性越强;
|
|
课
后
总
结
与
评
议
记
录
|
自
我
分
析
和
同
学
意
见
|
自我分析:
本节课教学设计在强调知识的具体重难点同时,在教学设计过程中也加入情景素材,调动学生积极性,并且也让他们真实地感受到水的电离。但是总体来说,教学设计还是显得有些纯知识点化,所以可能还需要更多思考,对于选修化学的教学,如何设计得更加吸引学生。
同学意见:
该同学本节课教学设计教学目标定位合理,教学重点难点突出,但希望教学过程中学生有自主学习的过程。
|
|
实习学校教学指
导
教
师
意
见
|
本节课教学目标明确,内容详实,重难点把握合理,条理清晰,在教学设计上应该多留给学生一些思考的空间,引导的问题也应该具有层次性,关注学生的思考过程。
|
|
|
我
校
指
导
教
师
意
见
|
教学知识点的重难点把握合理,教学内容符合教学课程标准。希望多一些驱动性和启发性的问题。
|
说明:1、本表由实习学生填写后分别请实习学校教学指导教师与我校指导教师给出评审意见,交所在部院系做实习评价使用,并将电子版上传至北京师范大学实践教学网。
2、在不便上网的地区实习的学生返校后整理材料,入校实习结束之后的两周内登录实践教学网提交。